Electroquímica. Piles. Potencial redox
2. Piles
Una pila voltaica o pila galvànica és un dispositiu que és capaç de transformar l'energia química d'una reacció redox espontània en energia elèctrica, per mitjà de la separació física de les dues semireaccions d'oxidació i de reducció. En totes les reaccions redox hi ha transferència d'electrons que pot servir per crear un corrent elèctric.
El disseny més elemental de pila voltaica és la pila Daniell, construïda el 1836 pel químic anglès John F. Daniell.
Il·lustració Wikipèdia
La Pila Daniell consisteix en dues làmines de metalls diferents submergides cadascuna en una solució diluïda que conté ions del mateix metall.
Cada parell (Metall/ solució ions metall) es coneix amb el nom de semicel·la o semipila.
A la làmina de metall se l'anomena elèctrode.
Un exemple de muntatge experimental de la pila Daniell és el seguent:

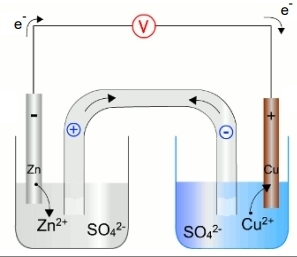
Illustració Fisquiweb
En ell hi veiem que les semireaccions d'oxidació i reducció se separen físicament en dos recipients i es connecten amb un tub en U, anomenat pont salí, que funciona com un envà porós. El pont salí conté un electròlit, els ions del qual no reaccionen amb els elèctrodes ni amb les dissolucions.
S'ha de permetre la circulació dels ions d'un got a l'altre sense que es barregin les dissolucions, la qual cosa s'aconsegueix tapant les dues branques del tub amb cotó o amb una membrana no permeable. La seva missió és tancar el circuit i mantenir la neutralitat elèctrica de tots dos gots.
Els electrons circulen del pol negatiu al positiu a través del conductor que els connecta. El voltímetre detecta la diferència de potencial entre els dos gots.
La combinació d'elèctrodes que es mostra a la figura:
Elèctrode de zinc / dissolució de ZnSO4; elèctrode de Cu / dissolució de CuSO4
constitueix l'anomenada pila o cel·la de Daniell. I proporciona un voltatge, força estable, de 1,10 V.
En el got de l'esquerra s'introdueix un elèctrode de zinc en una dissolució de ZnSO4 produint l'oxidació de Zn a Zn2 + segons:
A causa de la pèrdua d'electrons pels àtoms de zinc s'acumula càrrega negativa en l'elèctrode, amb la qual cosa, aquest adquireix un potencial negatiu. El metall (zinc) s'anirà dissolent a poc a poc a causa de la transformació dels àtoms de Zn metàl·lic a ions Zn2 + que passen a la dissolució.
A l'elèctrode d'aquesta cel·la se l'anomena ànode, ja que és l'elèctrode on té lloc l'oxidació.
En el got de la dreta s'hi introdueix un elèctrode de coure en una dissolució de CuSO4 produint ara la reducció del Cu2 + a coure metàl·lic (Cu) segons:
Com que l'elèctrode està a un potencial positiu respecte de l'elèctrode de zinc, els electrons flueixen cap a ell, reduint els ions Cu2 + a coure metàl·lic , la qual cosa manté la diferència de potencial entre els dos elèctrodes. El coure metàl·lic es dipositarà sobre l'elèctrode de coure.
A l'elèctrode d'aquesta cel·la se l'anomena càtode, ja que és l'elèctrode on té lloc la reducció.
El pont salí connecta els dos gots i està ple d'una dissolució d'un electròlit (KCl).
Les membranes que tanquen les dues boques impedeixen que les dissolucions es barregin permetent, però, que els ions circulin d'un got a un altre.
Com que en el got de l'esquerra (Zn | ZnSO4) salten contínuament ions Zn2 + a la dissolució, aquesta adquiriria un excés de càrrega positiva que impediria que nous ions positius s'incorporin a la dissolució. Això s'evita perquè des del pont salí s'injecten ions negatius que mantenen la neutralitat de la dissolució de sulfat de zinc.
En el vas de la dreta (Cu | CuSO4) passa justament el contrari: al retirar ions Cu2 + de la dissolució, aquesta adquiriria un excés de càrrega negativa (a causa de la presència d'ions SO4 2-) impedint que els ions Cu2 + es descarreguin en l'elèctrode. El pont salí subministra ions positius que, a el passar a la dissolució de sulfat de coure, mantenen la neutralitat de la mateixa.
L'efecte net del pont és establir una comunicació entre tots dos gots i "tancar el circuit", fent possible la circulació dels electrons pel circuit exterior.
• La reacció global per a una cel·la Daniell és:

. La notació de la pila, de manera abreujada és:
![]() Zn (s)|ZnSO4 (1M)||CuSO4 (1M)|Cu (s)
Zn (s)|ZnSO4 (1M)||CuSO4 (1M)|Cu (s)
• De forma general la notació d'una pila s'escriu d'esquerra a dreta de la següent manera:
ànode | Dissolució anòdica || Dissolució catòdica | Càtode
Una ratlla vertical indica un canvi de fase. Una doble ratlla vertical indica un envà porós o pont salí.