Equilibris químics iònics
Equilibris químics iònics
1. Teories àcid-base. Escala de pH
Teories àcid-base
Des de molt antic se sabia de l'existència de dos grups de compostos químics, els àcids i les bases (o àlcalis), que presenten propietats aparentment antagòniques:
• Els àcids donen coloració vermella amb l'indicador Tornasol, tenen sabor agre i produeixen efervescència a l'actuar sobre els carbonats.
• Les bases donen coloració blava amb l'indicador Tornasol, tenen gust amarg i neutralitzen els àcids al reaccionar amb ells.
Les fruites i les verdures contenen substàncies àcides, com l’àcid cítric de les llimones i les taronges, o l’àcid acètic del vinagre.
D'altra banda, bastants productes de la neteja domèstica contenen substàncies bàsiques, com l'amoníac.
La Química inclou en el grup dels àcids molts altres compostos, com l’àcid sulfúric o l’àcid clorhídric, i en el grup de les bases compostos com els hidròxids càlcic o sòdic.

Il·lustració Marta Pau
Des dels orígens...
Segons Lavoisier el que donava als àcids les seves especials característiques era la presència d'oxigen en la seva composició.
Lavoisier només coneixia el que avui anomenem oxoàcids (HNO3, H2SO4 ...) i desconeixia la composició dels àcids hidràcids (HCl, HF ...).
Humpry Davy va demostrar el 1810 que la teoria de Lavoisier era errònia al demostrar que els àcids hidràcids ( HF, HCl,...) no tenen oxigen.
Per Davy el veritable "principi acidificant" era l'hidrogen.
Principals models o teories àcid-base:
- Teoria d’Arrhenius
- Teoria de Brönsted-Lowry
- Teoria de Lewis.
Teoria d'Arrhenius

l·lustració Wikipèdia
Svante Arrhenius va definir els àcids (el 1884) com aquelles substàncies que, en dissolució aquosa (és a dir, al barrejar-los amb aigua) , s’ionitzen ( és a dir, es separen en ions) per donar ions H + i les bases com aquelles substàncies que, en dissolució aquosa, s'ionitzen (és a dir, es separen en ions) per donar ions OH-
Exemples:

Realment l'ió H + no existeix com a tal en dissolució , ja que, és un ió molt reactiu i s'incorpora a una molècula d'aigua formant H3O +
Per tant, caldria dir que un àcid (segons Arrhenius), és una substància que en dissolució aquosa dóna ions H3O +
HNO3 (aq) + H2O (l) → NO3- (aq) + H3O+ (aq)
- És vàlida per a dissolucions aquoses només, no ho és per a solvents diferents de l'aigua.
- Considera bases, aquelles substàncies que tenen OH- en la seva molècula. No pot justificar el caràcter bàsic de substàncies com l'amoníac, NH3 o el carbonat sòdic, Na2CO3.
- Considera àcids, aquelles substàncies que tenen H+ en la seva molècula i quan se dissocien en aigua donen H+. (Els ions hidrogen o protons, degut al seu petit radi, 10-13 cm, no existeixen sols en dissolucions aquoses, sino que estan hidratats, originant els ions hidroni, H3O+).
El 1932 Brönsted i Lowry van proposar (de manera independent), una teoria més àmplia que la d'Arrhenius, que era aplicable també a reaccions en dissolucions no aquoses.
La teoria de Brönsted-Lowry, per la seva generalitat, és usada àmpliament, tot i que actualment hi ha altres teories que amplien encara més el concepte d'àcid i base.
Teoria de Brönsted-Lowry


l·lustració Wikipèdia
El 1932 Brönsted i Lowry van proposar (de forma independent), una teoria més àmplia que la de Arrhenius, que explicava el comportament dels àcids i de les bases i que era aplicable també a reaccions en dissolucions no aquoses.
La teoria de Brönsted-Lowry, per la seva generalitat, és usada àmpliament, tot i que actualment hi ha altres teories que amplien encara més el concepte d'àcid i base.
Segons la teoria de Brönsted i Lowry:
Àcid és tota substància capaç de cedir H +
Base és tota substància capaç d'acceptar H +
Les reaccions àcid-base són en realitat reaccions de transferència d'H+, el que implica una espècie que doni i una altra que accepti.
Exemple:
HNO3 (aq) + H2O (l) → NO3- (aq) + H3O+ (aq)
Aquesta teoria fou formulada de forma independent al 1923 per Brönsted i Lowry.
1-Amplia el concepte de base ja que explica com substàncies amb caràcter bàsic que no tenen OH-, es comporten com a bases.
En el cas dels hidròxids el que és una base de Brönsted és l'ió hidròxid (OH -) que es forma quan el compost es dissol en aigua, ja que pot acceptar un protó:
![]()
Na(OH) (s) → Na+ (aq) + OH-(aq)
OH-(aq) + H3O+ (aq) → 2 H2O (l)
2- Permet explicar una reacció en dissolució no aquosa:
![]()
Segons la teoria de Brönsted:
1-Quan un àcid cedeix un H+ es transforma en una espècie que pot acceptar un H+. Això, és, en una base de Brönsted.
2- Quan una base capta un H+ es transforma en una espècie capaç de cedir un H+. És a dir, en un àcid de Brönsted.
S'anomena base conjugada d'un àcid de Brönsted a l'espècie que resulta després de cedir un H+
S'anomena àcid conjugat d'una base de Brönsted a l'espècie que resulta després de captar un H+
![]()
La teoria de Brönsted-Lowry no pot justificar el caràcter àcid de les substàncies que no tenen protons en la seva fórmula (AlCl3,BF3...).
Teoria de Lewis

Gilbert Newton Lewis
l·lustració Wikipèdia
1- Els àcids són substàncies que poden acceptar un parell d'electrons.
2- Les bases són substàncies que poden cedir un parell d'electrons.
Aquesta és una definició molt més àmplia, en la qual hi queden incloses les dues teories anteriors, per la qual cosa, totes les substàncies que són àcids i bases segons les teories d'Arrhenius i Brönsteb-Lowry, ho són també segons la teoria de Lewis.
Mesura de l'acidesa. Escala de pH.
Sörensen va proposar (el 1909) l'escala de pH per a mesurar l'acidesa de les dissolucions aquoses.
Es defineix el pH com el logaritme negatiu de la concentració molar d'ions H3O +
En química les substàncies, segons el seu pH, es classifiquen en:
- Àcides
- Bàsiques
- Neutres
Per tal de fixar una referència considerem l'aigua pura com a substància neutra.
L'aigua és capaç d'actuar com a àcid o com a base. Les substancies que, com l'aigua, poden comportar-se com a àcid i com a base segons el tipus de compost amb qui reaccionin s'anomenen amfòters o amfipròtics.
Com que l'aigua és una substància amfòtera, es dona la reacció àcid-base entre dues molècules d'aigua.
Aquesta reacció s'anomena reacció d'autoionització o equilibri iònic de l'aigua. En aquesta reacció, una molècula actua com a àcid cedint un protó i l'altra actua com a base acceptant un protó.
Equilibri d'autoinització de l'aigua
l·lustració Wikipèdia
Aquest equilibri està molt desplaçata cap a l'esquerra, cap a la formació d'aigua, perquè només unes poques molècules d'aigua estan ionitzades.
![]()
L'expressió de la constant d'equilibri per aquesta reacció és:
El fet que la quantitat de molècules dissociades és molt petita fa que la concentració d'aigua sigui pràcticament constant. Per tant, s'inclou la concentració d'aigua, [H2O]2 dins la constant d'equilibri:
I s'arriba a l'expressió de Kw, que rep el nom de constant d' autoionització de l'aigua o producte iònic de l'aigua.
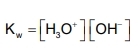
Per a l'aigua pura, i a 25 0C, el valor de Kw és 10 -14.
Com que les concentracions de H3O + i OH- són iguals:
En l'aigua pura a 25ºC, sempre se compleix:

Per tant el pH de l'aigua pura valdrà:
![]()
L'aigua és una dissolució neutra ja que té la mateixa quantitat d'ions H3O+ i de ions OH-.
Si addicionem un àcid a aigua pura, augmentarem la concentració d’H3O+ i la concentració d’OH- disminuirà per mantenir constant K w. Tindrem una dissolució àcida : [H3O+] > 10-7 M i [OH ] <10-7 M
Si addicionem una base a l'aigua pure, el que augmentarà serà la concentració d’OH- , mentre que la concentració d’ions H3O+ disminuirà. Tendrem una dissolució bàsica: [H3O+ ] < 10-7 M i [OH-] > 10-7 M
Per tant:
Qualsevol substància àcida donarà lloc a una concentració d'ions H3O + superior a 10 -7 (10-6, 10-5, 10-4 ...) i, en conseqüència, tindrà un pH inferior a 7.
Qualsevol substància bàsica donarà lloc a una concentració d'ions H3O + inferior a 10 -7 (10-8, 10-9, 10-10 ...) i, en conseqüència, tindrà un pH superior a 7.
pH d'algunes substàncies
Il·lustració Marta Pau
Quan més alt sigui el valor del pH, més bàsica és la dissolució. Quan més baix sigui el valor del pH, més àcida és la dissolució.
D'igual manera com s'ha definit el pH podem definir el pOH com el logaritme negatiu de la concentració molar d'ions OH -
![]()
És possible establir una relació entre pH i pOH a partir de la Kw:
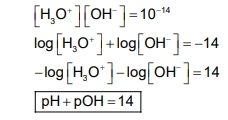

Relació pH-pOH
l·lustració Wikipèdia
Experimenta amb el pH
- Quin és el pH d'un àcid fort?
- I d'un àcid feble?
- I d'una base forta?
- I d'una base feble?
Ho descobriràs posant-te a prova amb la simulació següent: