Equilibri químic
1. Equilibri químic. Quocient de la reacció
Quan té lloc una reacció química ens podem trobar amb els casos següents:
1) Les concentracions inicials dels reactius van disminuint amb el temps fins que (si les quantitats són les estequiomètriques) s'esgoten del tot i obtenim, exclusivament, els productes de la reacció.
Això succeeix quan els productes són molt més estables que els reactius en les condicions en què es duu a terme la reacció, o quan un dels productes deixa el medi de la reacció degut a la formació d'un precipitat insoluble, del despreniment en forma de gas ...
Exemple 1:
![]()
Iodur potàssic Nitrat de plom (II) Diiodur de plom Nitrat potàssic
Si fem reaccionar una dissolució de iodur de potassi amb una altra de nitrat de plom (II) (ambdues són, a baixes concentracions, pràcticament incolores) es forma un precipitat altament insoluble de diiodur de plom (groc intens), quedant en dissolució el nitrat de potassi format. Com que pràcticament la totalitat dels ions I - i Pb2 + desapareixen de la dissolució (ja que formen el PbI2 insoluble) la reacció progressa fins que els reactius es transformen íntegrament en els productes.

Precipitació del diiodur de plom
Exemple 2:
Quan un tros de zinc s'introdueix en àcid clorhídric s'observa el despreniment d'hidrogen gas que escapa de la dissolució. En aquest cas la reacció transcorre fins que els reactius s'esgoten del tot.
![]()
Zinc Àcid clorhídric Clorur de zinc Hidrogen
2) Les concentracions inicials dels reactius disminueixen amb el temps (reacció directa), però els productes formats reaccionen entre si per tornar a donar els reactius (reacció inversa).
Com que en les reaccions químiques, les velocitats de reacció depenen de les concentracions de les substàncies que reaccionen, la velocitat de la reacció directa és molt alta al principi i va disminuint a mesura que desapareixen els reactius. Anàlogament la velocitat de la reacció inversa és lenta a el principi (la concentració dels productes és petita), però augmenta amb el temps a mesura que es van formant els productes.
Arribarà un moment en què les velocitats de la reacció directa i inversa s'igualen. A partir d'aquest moment observarem que les concentracions de reactius i productes es mantenen constants.
Quan arribem a aquesta situació podem tenir la impressió que la reacció s'ha aturat, cosa que no és certa.
El que passa és que les substàncies es formen a la mateixa velocitat que es descomponen. Per dir-ho gràficament, tenim sempre la mateixa quantitat de molècules d'una determinada substància, però no són les mateixes molècules, ja que es formen i es descomponen contínuament.
El principi de reversibilitat microscòpica estableix que en qualsevol sistema en equilibri qualsevol procés molecular i l'invers es produeixen, de mitjana, a la mateixa velocitat.
Quan la reacció arriba a aquest estat es diu que s'ha assolit l'equilibri, o que el sistema està en equilibri (equilibri dinàmic, ja que la reacció no s'atura).
Exemple:
El tetròxid de dinitrogen gasós es descompon en diòxid de nitrogen que, al seu torn, torna a donar l'òxid original. Per tal d'indicar que la reacció transcorre en ambdues direccions s'escriu una doble fletxa.
N2O4 ↔ 2NO2
A la taula següent s'observa la variació amb el temps de les concentracions dels compostos implicats:
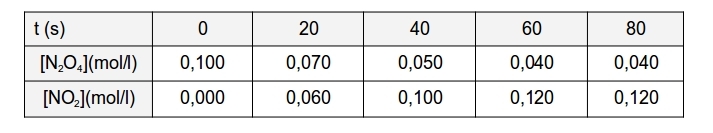
A la taula es pot observar:
• Que la concentració de N2O4 disminueix amb el temps (cada vegada més lentament)
• Que la concentració de NO2 augmenta amb el temps (cada vegada més lentament)
• Que a partir de determinat instant les concentracions de tots dos compostos romanen inalterades (encara que no són iguals).
Constant d'equilibri en funció de les concentracions molars (Kc)
La discussió anterior ens permet establir les condicions d'equilibri, ja que es pot demostrar que per a una reacció general que es trobi en estat d'equilibri:

El quocient:

és constant (llei d'acció de masses). En aquest quocient [A] representa la concentració d'A en mols/L;
[B] representa la concentració de B en mols/L i [C] i [D], les concentracions de C i D en mols/L.
Aquiest quocient, on les concentracions de reactius i productes estan expressades en mol / litre, rep el nom de constant d'equilibri en funció de les concentracions molars, Kc.


• El valor de la constant d'equilibri varia amb la temperatura (per aquest motiu sempre ens donen la dada de la temperatura a la que es verifica la reacció).
• La seva expressió (i per tant el seu valor numèric) depèn de la forma en què estigui ajustada l'equació corresponent.
Exemples:

• Si en la reacció hi intervenen sòlids o líquids purs, atès que la seva concentració és constant, es considera inclosa en el valor de la constant d'equilibri.

Més exemples:

• Si s'inverteix una reacció química, la constant d'equilibri de la reacció és la inversa de la reacció directa.


• Si se sumen dues equacions per donar una tercera, la constant d'equilibri d'aquesta és el producte de les dues primeres.

• La Kc s'expressa sense unitats.
L'expressió de la constant d'equilibri ens subministra una equació mitjançant la qual podem realitzar càlculs referents a l'estat d'equilibri.
