Biomolècules
5. Proteïnes (repàs 1r)
Les proteïnes (repàs 1r)
Les proteïnes són cadenes lineals d’aminoàcids,units per enllaços peptídics.
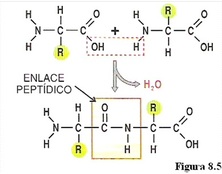
Es diferencien entre si pels aspectes següents:
• El nombre d’aminoàcids ,segons el qual es classifiquen de la manera següent:
– Si en contenen menys de 100,són pèptids (si en tenen dos,són dipèptids;tres,tripèptids;fins a deu,oligopèptids;fins a cent, polipèptids).
– Si en contenen més de 100, són proteïnes (generalment fins a dos mil).
• La seqüència condiciona el plegament de la cadena i, per tant, l’activitat biològica de la proteï- na està codificada a la seqüència de nucleòtids dels àcids nucleics. Els aminoàcids són compostos amb un grup carboxil (COO– ), un grup amino (NH3 + ) i una cadena lateral (R) que els fa diferents.Hi ha 20 tipus d'aminoàcids diferents a les proteïnes.
Les característiques dels aminoàcids són les següents:
• Són solubles en aigua.
• A un pH = 7,tant el grup amino com el grup carboxil estan ionitzats.
Estructura de les proteïnes
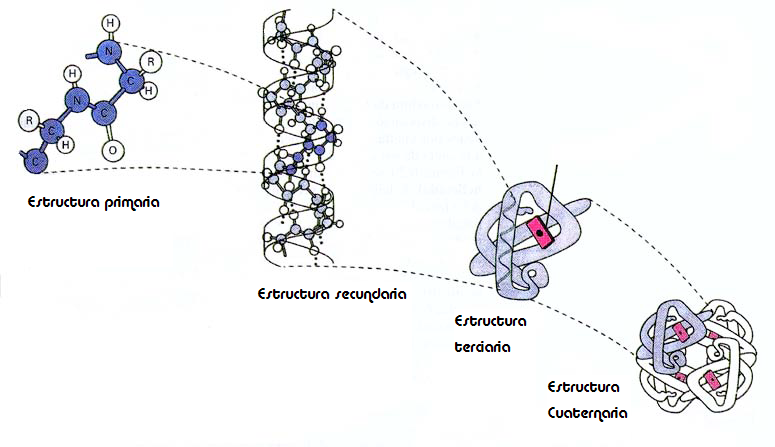
La forma de les proteïnes, essencial per a la seva funció biològica, por analitzar-se a quatre nivells:
• Estructura primària: seqüència (ordre a la cadena) dels seus aminoàcids .
o El nombre possible de combinacions de 20 aminoàcids, repetits o no, és il·limitat.
o Hi ha bancs de dades accessibles per Internet totes les estructures primàries conegudes.
• Conformació: la forma tridimensional
o La cadena d’aminoàcids es plega sobre ella mateixa adoptant una forma o conformació de mínima energia (amagant a l’interior les cadenes laterals hidrofòbiques, exposant les cadenes hidrofíliques, establint enllaços entre zones de la mateixa cadena (disulfur, d’hidrogen, de Van der Waals, iònics, etc.). Forma les estructures secundària i terciària.
• Estructura secundària: patrons locals de plegament o En comparar les conformacions de moltes proteïnes es veu que existeixen uns patrons de plegament, que són comuns a moltes cadenes. o Els més generals són l’hèlix α i la làmina β (o full plegat)
• Estructura terciària: plegament general
o És característic de cada proteïna.
o Hi ha proteïnes fibroses (conformació allargada) i globulars (conformació arrodonida)
• Estructura quaternària: associació de proteïnes,
o Iguals o diferents entre si.
o Per enllaços no-covalents
Activitats biològiques de les proteïnes
• Presenten una gran variabilitat d’estructures i d’activitats biològiques:
Enzims (faciliten les reaccions bioquímiques), components estructurals (citoesquelet, cilis i flagels, components intercel·lulars (el col·lagen a teixits connectius), hormones, receptors, transportadors (de membrana, pel citosol, per la sang de ferro, oxigen), anticossos, components contràctils (actina i miosina), factors de coagulació, etc.
• Depenen de la seva conformació, ja que permet o no l’encaix perfecte imprescindible amb les molècules amb les que interaccionen (o lligands: substrats, antígens, ions, etc.)
o Desnaturalització: pèrdua del plegament d’una proteïna, mitjançant algun tractament químic (calor, pH, dissolvents). Comporta la pèrdua de la seva activitat biològica
o Renaturalització: recuperació de la conformació original (nativa) i de l’activitat biològica. Només és possible en alguns casos i condicions.