Electroquímica. Piles. Potencial redox
3. Potencials de reducció
En una pila, quan s'unieixen les dues semicel·les amb un fil conductor, es crea una diferència de potencial elèctric (ddp) entre els elèctrodes.
Aquesta diferència de potencial és la que provoca que els electrons circulin des de l'ànode (oxidació) fins el càtode (reducció).
Sense diferència de potencial no hi hauria moviment d'electrons ni tampoc reacció redox.
La diferència de potencial se mesura en volts (V).
El voltímetre ens permet mesurar la diferència de potencial entre els elèctrodes d'una pila.
És possible mesurar el potencial (E) de cada semicel·la de la pila?
Això no és possible a través del muntatge de la pila.
Per poder calcular-los s'assigna arbitràriament a una semicel·la un valor de potencial igual a zero, i aquest es pren com a referència.
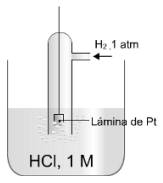
Per convenció s'ha elegit l'elèctrode estàndard d'hidrogen com a referència, i se li assigna un potencial anomenat estàndard:
Eº=0 V.
L'elèctrode estàndard o normal d'hidrogen és un elèctrode de gas parcialment submergit en una dissolució d'un àcid fort on la concentració de H+ és 1M, en el qual s'injecta H2 a 1 atm pressió per l'orifici de la part superior del tub de vidre. La reacció que té lloc a la superfície de l'elèctrode és:
Com es veu a la reacció, a l'elèctrode d'hidrogen pot donar-se una oxidació o una reducció.
Les condicions estàndard consisteixen en una temperatura de 25ºC, una pressió parcial d’1 atm pels gasos i una concentració 1 M per les substàncies dissoltes.
Càlcul del potencial estàndard d'un elèctrode
El potencial estàndard d'elèctrode és el potencial que té l'elèctrode en una pila formada per ell mateix i l'elèctrode estàndard d'hidrogen, que se li ha assignat potencial zero. Tot en condicions estàndard.
Criteri signes del potencial estàndard
Per poder comparar els potencial estàndard dels diferents elèctrodes es considera el potencial de les semireaccions quan es produeixen en el sentit de reducció.
Aquests potencials s'anomenen potencials de reducció estàndard i els simbolitzam amb Eº (Mn+/M).
- Si una semireacció de reducció, en condicions estàndard, es produeix amb més facilitat que la reducció de H+, assignarem un valor positiu al seu potencial de reducció estàndard.
- Si una semireacció de reducció, en condicions estàndard, és més difícil que la reducció de H+ , assignarem un valor negatiu al seu potencial de reducció estàndard.
Potencials estàndard de reducció
Alguns potencials d'elèctrode
Il·lustració Wikipèdia
Reaccions redox
Per saber el sentit de la reacció redox hen de mirar el valor dels potencials redox de les dues espècies implicades.
Com més positiu és el potencial estàndard de reducció més gran serà la tendència a reduir-se i més gran serà el seu poder oxidant.
Com més negatiu és el potencial estàndard de reducció més gran serà la tendència a oxidar-se i més gran serà el seu poder reductor.
Una espècie és més oxidant (té molta tendència a reduir-se) com més gran és el seu potencial estàndard de reducció, i més reductora (té molta tendència a oxidar-se) com més petit és aquest potencial.