Solucionari_Tramesa de problemes_Q2_B1_4
TRAMESA DE PROBLEMES Q2_B1_4
Problema 1 (5 punts)
En un matràs de 250 cm3, a la temperatura de 27ºC, s'hi van introduir 213 mg de fosgè (COCl2).
Quan es va haver assolit l'equilibri, la pressió a la que va arribar el matràs va ser de 230 mm de Hg.
COCl2(g) ↔ CO(g) + Cl2(g)
Calculeu:
a) La pressió parcial de cada gas en l'equilibri.
Dades:
V = 0,25 L
T = 300 K
Ptotal = 230 mm Hg = 0,3 atmosferes
1- Calculem el nombre de mols de fosgè:

2- En l'equilibri es compleix:

A partir de l'equació dels gasos, dels mols totals a l'equilibri (0,002-x+x+x) i de la pressió total, podem trobar els mols dissociats i, per tant els mols en l'equilibri de cada gas.
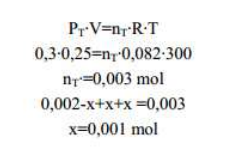
Aplicant l'equació dels gasos a cada gas, calculem la pressió parcial a l'equilibri del mateix.

b) Els valors de les constants d'equilibri Kc i Kp.
1- Per calcular la constant Kc, primerament calculem les concentracions de cada gas a l'equilibri:
Calculem la constant Kc i la Kp
R/ a) P(fosgè) = 0,0984 atm; P(CO) = P(Cl2) = 0,0984 atm ; b) Kc = 0,004; Kp =0,0984
Problema 1 (5 punts)
La següent reacció
2HI (g) ↔ H2 (g) + I2 (g)
té Kc = 0,018 a 700º C
a) Determineu si una mescla de 1 mol HI, 1 mol de H2 i 2 mols de I2 està en equilibri a 700ºC.
Per a comprovar-ho, calculem el quocient de concentracions i comparem el seu valor amb el de la constant d'equilibri de la reacció.
b) Una segona mescla a igual temperatura, està formada per 0,2 mols de HI, 0,1 mols de H2 i 0,5 mols de I2. Si no està en equilibri, en quin sentit transcorrerà la reacció? Justifiqueu la vostra resposta.
Per a comprovar si la mescla està en equilibri calculem el quocient de concentracions i comparem el seu valor amb el de la constant d'equilibri de la reacció.
Per saber cap on evolucionarà la reacció, apliquem el principi de Le Chatelier.
c) Calculeu per a la segona mescla el nombre de mols de cada component en l'equilibri.
R/ c) HI= 0,386 mols; H2 = 0,007 mols; I2 = 0,407 mols
Ànims!