Enunciats de la tramesa de problemes Q2_B1_2
Enunciats de la tramesa de problemes Q2_B1_2
Activitats
Benvolguts estudiants,
A fi de tenir la màxima puntuació en aquesta activitat, és important que en la resolució de tots els problemes:
1. Anoteu les dades que es donen i les que es demanen.
2. Incloeu tot el procediment i operacions que feu per arribar al resultat de cada apartat.
3. Expliqueu/justifiqueu breument cada apartat del procediment seguit.
4. Expresseu tots els resultats amb el seu valor numèric i les unitats corresponents.
5. Envieu el fitxer en format pdf.
Tingueu present que la tramesa de problemes ha de ser una tasca individual, com també ho és la nota de la mateixa. No obstant, si es donés el cas que una tramesa fos còpia d'una altra o d'altres, totes elles s'avaluarien amb 0 punts.
Ànims!
1. (3 p) La següent reacció correspon a la reacció d'hidrogenació de l'etè a età.
C2H4 (g) + H2 (g) → C2H6 (g)
A partir de les dades entàlpiques de les reaccions següents, calculeu l'entalpia estàndard per a la reacció d'hidrogenació de l'etè.
C2H6 (g) + O2 (g) → 2 CO2 (g) + 3 H2O (l) ΔH° = -1560,9 kJ
H2 (g) + O2 (g) → H2O (l) ΔH° = -285,8 kJ
C2H4 (g) + 3 O2 (g) → 2 CO2 (g) + 2 H2O (l) ΔH° = -1411,9 kJ
Pista: Podeu aplicar la llei de Hess
R/ ΔH° = -136,8 kJ
2. (3 p) La reacció d'oxidació catalítica de l'amoníac és el punt de partida per a l'obtenció industrial de l'àcid nítric i es produeix segons l'equació:
4 NH3 (g) + 5 O2 (g) → 6 H2O (l) + 4 NO (g)
Calculeu l'entalpia estàndard d'aquesta reacció a partir de les dades de les entalpies estàndard de formació.
ΔH°f [NH3(g)] = -46,3 kJ · mol-1 ; ΔH°f[O2(g)] = 0
ΔH°f[NO(g)] = + 90,4 kJ · mol-1; ΔH°f[H2O(l)] = -285,8 kJ · mol-1
Sol.: ΔH° =-1168 kJ.
3. (4 punts) En la taula següent hi tens dades d'energies d'enllaç:
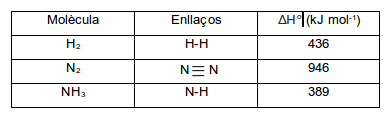
A partir de les dades de la taula, calculeu l'entalpia estàndard de formació de l'amoníac.
Pista: Recordeu que heu de tenir present els enllaços que es trenquen i els que es formen en el procés.
R/ ΔH°f NH3 = -40 kJ/mol
Ànims!