Posa't a prova amb els problemes d'espontaneïtat i velocitat de les reaccions químiques (I)
Exercicis
1. Un dels principals irritants oculares del smog (boira provocada per la contaminació atmosfèrica) es el formaldehid CH2O,
que es forma en la reacció:
C2H4 (g) + 03(g) → 2 CH2O( g ) + 1/2 O2(g)
Hem fet diferents experiments, a 25oC, per determinar la velocitat inicial de reacció a diferents concentracions i hem obtingut els resultats següents:
a) Determineu l'ordre parcial de la reacció respecte cada un dels reactius i l'equació de velocitat de la reacció.
b) Determineu la constant de velocitat de la reacció.
c) Calculeu la velocitat de reacció quan [C2H4] i [03] són 3,0 · 10-7 mol/L .
Solució
a) Suposem per la llei de la velocitat : v = k [C2H4]a [O3]b
A partir dels experiments 1 i 2 veiem que la concentració d'ozó és constant: [O3] = constant i d'altra banda: v2 / v1 = [C2H4]2a / [C2H4]1 a
a = ln (v2 / v1) / ln ([C2H4]2 / [C2H4]1)
a = ln (3 x 10-12 / 1 x 10-12) / ln (1,5 x 10-7 / 0,5 x 10-12) = ln 3 / ln 3 = 1
a = 1 (ordre parcial de l’etilè)
A partir dels experiments 1 i 3:
v3 / v1 = ([C2H4]3 / [C2H4]1)a · ([O3]3 / [O3]1) b ⇒
⇒b = ln ((v3 / v1) ([C2H4]3 / [C2H4]1)) / ln ([O3]3 / [O3]1)
b = ln ((4 x 10-12 / 1 x 10-12) (0,5 x 10-7 / 1 x 10-7 )) / ln (2 x 10-8 / 1 x 10-8 ) = ln 2 / ln 2 = 1 ⇒ b = 1 (ordre parcial de l’ozó)
Ordre total: n = a + b = 1 + 1 = 2;
n = 2
b) Si ens centrem en l'experiment 1 (es pot treballar amb qualsevol dels tres experiments):
v1 = k [C2H4]1 [O 3]1 ⇒ k = v1 / ([C2H4]1 [O3]1)
k= 1,0 x 10-12 mol L-1 s -1 / ((0,5 x 10-7 mol L-1) (1,0 x 10-7 mol L-1)) = 2000 L mol-1 · s -1
k = 2000 L mol-1 · s -1
c) Aplicant els valors d'α i β obtinguts als exercicis anteriors i la concentració que s'indica:
v = k [C2H4]1 [O3]1 = 2000 L · mol-1 · s-1 · (3,0 · 10-7 mol · L-1) · ( 3,0 · 10-7 mol · L-1 ) =
= 2000 L · mol-1 · s-1 · (3,0 · 10-7 mol · L-1 )2 =
2000 L · mol-1 · s-1 · (9,0 · 10-14 mol2 · L-2 ) = 1,8 · 10-10 mol · L-1 · s-1
2. Per la reacció N2O4( g) →2 NO 2 (g), la velocidad de formació de l'NO 2 (g), en cert interval de temps , val 0,004 mol · L-1 · s-1
Quant val en aquest interval la velocitat de desaparició de l'N2O 4(g)?
Solució
Tenint en compte l'estequiometria de la reacció, per cada mol de N2O4(g) que desapareix es formen dos mols de NO2 (g).
És a dir que Δ[NO2] = - 2Δ[N2O4]
Per tant, vdesc N2O4 = -Δ[N2O4]/Δt = 1/2 ·Δ[NO2]/Δt = 1/2 · vaparent NO2 =
= 1/2 · (0,0004) = 0,002 mol · L-1 · s-1
3.El bromur de metil s'obté del metanol mitjançant una reacció de substitució catalitzada en medi àcid:

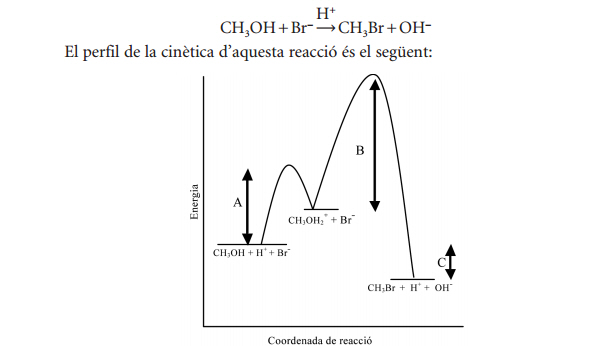
Responeu les preguntes següents, justificant en tots els casos les vostres respostes:
a) Quines magnituds representen les lletres A, B i C? .
A: representa d’energia d’activació de la primera etapa del mecanisme de reacció (reacció del metanol amb H+per formar CH3OH2+ ).
B: representa d’energia d’activació de la segona etapa del mecanisme de reacció (reacció del CH3OH2+amb Br- per formar CH3Br, H+i OH-).
C: representa l’entalpia de la reacció global.
b) Quina de les etapes del mecanisme de la reacció és la més lenta?
L’etapa més lenta del mecanisme de reacció és la segona, perquè té l’energia d’activació més alta. Els reactius d’aquesta etapa tenen més dificultat per formar els productes que no els de la primera etapa.
c) La reacció d'obtenció del bromur de metil a partir de metanol en un medi àcid és exotèrmica o endotèrmica?
La reacció de formació del bromur de metil a partir de metanol, catalitzada en medi àcid, és exotèrmica, ja que en el diagrama es visualitza que l’energia dels productes és menor que la dels reactius.
d) Expliqueu què s’entén per intermedi de reacció i per estat de transició (o complex activat). Quants intermedis de reacció i quants estats de transició hi ha en el mecanisme de la reacció d’obtenció del bromur de metil a partir de metanol?
Un intermedi de reacció és una substància que es forma en una de les etapes d’un mecanisme de reacció, però que reacciona en una altra etapa, degut a que és una espècie força reactiva. No apareix en la reacció global, ni com a reactiu ni com a producte.
Un estat de transició o complex activat és el punt del diagrama energia versus coordenada de reacció que té més energia que els reactius i que els productes, en una etapa del mecanisme de la reacció.
En el mecanisme de reacció de formació del bromur de metil a partir de metanol, en medi àcid, tenim:
- Un intermedi de reacció: l’ió CH3OH2+
- Dos estats de transició (un per cada etapa del mecanisme)

Modifié le: jeudi 30 janvier 2020, 14:38