Posa't a prova amb els problemes d'equilibri químic (I)
Posa't a prova amb els exercicis següents d'equilibris de fases

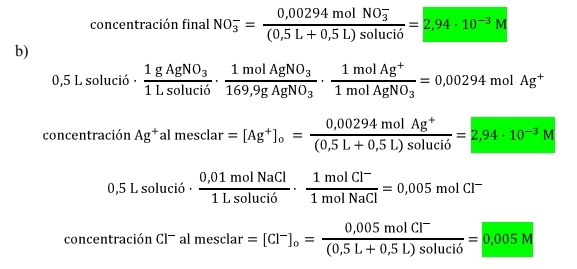

5. Sabent que el producte de solubilitat del AgCl és 1,7 ·10-10, a 25oC.
Indiqueu fent els càlculs necessaris si es formarà o no precipitat a l'afegir a un litre de dissolució 0,1 M de AgNO3, 1 litre de dissolució 0,1 M de HCl.
(considereu que els volums són additius)
AgCl ↔ Ag + + Cl -
Q = [Ag +] · [Cl-] = 2,5 · 10 -3 > Ks, per tant es formarà precipitat
6. Sabent que per l'AgCl, Ks = 1,7 · 10-10 a 25o C, calculeu:
a) [Ag+] quan es dissol AgCl en aigua pura.
Ks = s2
s = 1,3 · 10 -5 M
b) [Ag+] quan a aquesta solució se li afegeix NaCl fins a que la seva concentració sigui 0,1 M.
Ks = [Ag +] · [Cl-] = x · 0,1
x = 1,7 · 10-9 M
7. Calculeu:
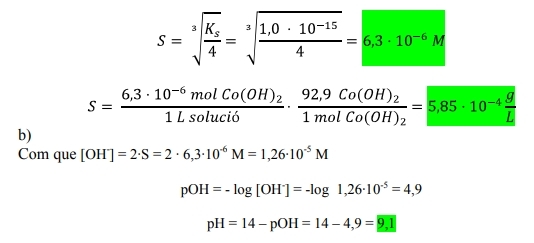
a) La solubilitat de l’hidròxid de plata expressada en mol/L i en g/L.
Ks = [Ag +] · [OH-]
2,0·10-8 = s · s
s = 1,4142 · 10-4 M
i multiplicant per la massa molar de l'hidròxid de plata , s =1,77 · 10-2 g/L
b) El pH d'una dissolució saturada d'hidròxid de plata.
pOH = 3,85 ; pH = 14 - 3,85 = 10,15
(Dades:Ks (AgOH) = 2,0·10-8)