Mols, dissolucions
EL MOL
1. ELEMENTS I COMPOSTOS
A la Taula periòdica hi trobem els diferents elements químics.
Els àtoms de diferents elements químics poden unir-se mitjançant un enllaç (iònic o covalent) formant un compost.
2. MASSA ATÒMICA (A)
La massa d'un àtom s'anomena massa atòmica, es representa per A i el seu valor el trobem a la Taula Periòdica (en algunes Taules periòdiques la trobarem com a Pes atòmic).
La massa atòmica no es mesura en kg, ni en g, ni en mg, ja que són unitats molt grans comparades amb la massa d'un àtom.
La unitat que s'ha escollit per a mesurar la massa atòmica és diu: unitat de massa atòmica i es simbolitza per u.
Una u correspon a una massa molt petita, concretament a la massa d'un àtom de Carboni-12 dividida per 12 (és a dir una u és igual a una dotzena part de la massa d'un àtom de C-12).
Sovint però, la massa d'un àtom o massa atòmica s'expressa en termes relatius (Ar), és a dir, sense unitats (però hem de tenir clar que si li posem unitats, aquestes seran u)
Exemples de masses atòmiques:
A la taula periòdica hi trobem que les masses atòmiques relatives d'un àtom de ferro, d'un àtom d'hidrogen i d'un àtom d'oxigen són:
A (Fe) = 55,85
A (H) = 1
A (0) = 16
3. MASSA MOLECULAR (M)
La massa d'una molècula s'anomena massa molecular i es simbolitza per la lletra M.
La massa molecular o massa de la molècula es calcula sumant les masses dels àtoms que formen la molècula.
La massa d'una molecula o massa molecular es pot expressar amb unitats (u) o sense unitats (parlem de massa molecular relativa Mr).
Exemple:
Càlcul de la massa molecular de l'aigua (H20)
Masses atòmiques relatives:
H = 1
O = 16
La massa molecular o massa d'una molècula d'aigua es troba sumant les masses dels àtoms que formen la molècula d'aigua, és a dir, sumant la massa de 2 àtoms d'hidrogen més la massa d'1 àtom d'oxigen.
Mr (H2O) = 2 · 1 + 1· 16 = 18
La massa molecular relativa de l'aigua és 18.
4. EL NOMBRE D’AVOGADRO
El nombre 6,02. 10 23 és un nombre molt important en química.
Rep el nom de Nombre d'Avogadro i es simbolitza per NA
5. EL MOL
Un mol es defineix com la quantitat de substància que contiene 6,02.1023 unitats elementals (que poden ser àtoms, molècules, ions...).
1 mol d'àtoms conté 6,02. 10 23 àtoms
1 mol de molècules conté 6,02. 10 23 molècules
1 mol d'ions conté 6,02. 10 23 ions
D'igual manera que una parella són 2 unitats elementals (dues persones, dos àtoms, dos llibres, dues molècules...), un mol són 6,02.1023 unitats elementals.
I és important tenir en compte a) b) i c):
a) Un mol es defineix com la quantitat de substància que conté
6,02.1023 unitats elementals.
b) La massa d'1 mol d'àtoms coincideix amb la massa d'1 àtom, però expressada en g.
c) La massa d’1 mol de molècules coincideix amb la massa d’1 molécula, però expressada en g.

6. CÀLCULS ENTRE GRAMS I MOLS I MOLS I GRAMS
Els càlculs entre mols i grams són molt importants en aquest tema, però també en la resta de temes de química.
Pas de grams a mols (cal mirar les masses atòmiques a la Taula periòdica)
Exemple 1
Quants mols són:
a) 7,0 g de Na?
b) 20,5 g de H2O?
c) 64,8 g de H2SO4?
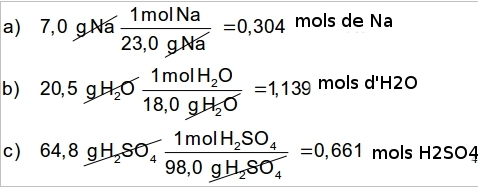
Pas de mols a grams (cal mirar les masses atòmiques a la Taula periòdica)
Exemple 2
Necessitem tenir:
1,20 mols de Zn.
0,25 mols de CH4
3,40 mols de H2CO3
Quants grams hem de pesar de cada substància?
1. Grams i mols
1.1. Dissolucions
Dissolucions
1. LA MATÈRIA
Matèria és tot el que té massa i volum.
Només cal fer una ullada al nostre voltant per adonar-nos que la matèria és diversa: fusta, ciment, plàstic, aire ...
Hi ha diverses substàncies o tipus de matèria.
La massa i el volum són propietats generals de la matèria. Qualsevol substància té massa i volum.
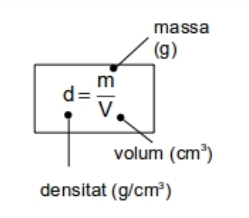
Si dividim la massa d'un cos entre el volum que ocupa s'obté una nova magnitud: la densitat.
La densitat és una propietat característica de les substàncies (cada substància té una densitat) i pot servir per a identificar-les.
Tot i que la unitat de densitat de l'S.I. és el kg / m3 s'empra molt el g / cm3
1 g / cm3 = 1kg/L = 1 000 kg / m3 = 103 kg / m3
2. LES DISSOLUCIONS
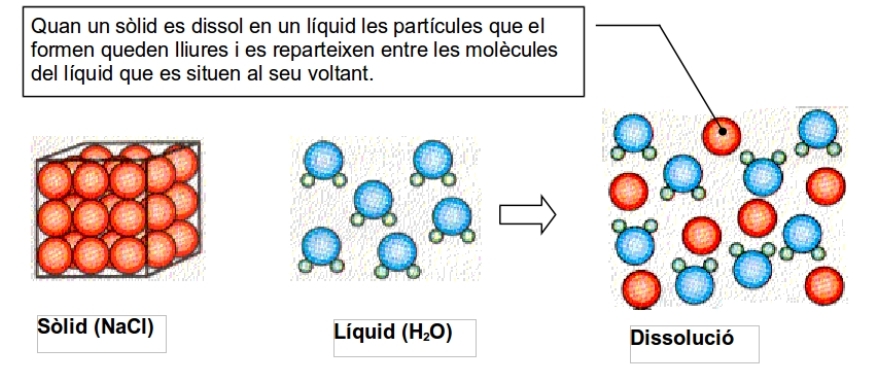
Una dissolució (o solució) és una mescla homogènia de dues o més substàncies, els components de la qual no es poden distingir a simple vista.
En les dissolucions cal distingir el solut, el dissolvent i la pròpia dissolució.
Solut, és la substància que es dissol.
Dissolvent (o solvent), és la substància en la qual es dissol el solut.
Dissolució (o solució), és el conjunt format pel solut i el dissolvent.
En aquells casos en què hi pugui haver dubte sobre quin és el solut i quin el dissolvent es considera dissolvent al component que hi està en major proporció i solut al que s'hi troba en menor proporció.
Hi ha molts tipus de dissolucions. S'esmenten a continuació les més importants:
Dissolucions sòlid - líquid. Exemple: sucre i aigua. El solut és el sòlid i el dissolvent el líquid.
Dissolucions líquid - líquid. Exemple: alcohol i aigua. Si preparem una dissolució barrejant 250 cm3 d'alcohol i 500 cm3 d'aigua, el solut serà l'alcohol i el dissolvent l'aigua.
Dissolucions líquid - gas. Exemple: oxigen i aigua. El solut és el gas, el dissolvent el líquid.
Dissolucions gas - gas. Exemple: l'aire. Es considera solut l'oxigen (21%) i dissolvent el nitrogen (79%) (considerant que l'aire està format només per oxigen i nitrogen).
El procés de dissolució
Quant solut es pot dissoldre en una quantitat donada de dissolvent?
Podem contestar que una quantitat màxima. Si anem afegint solut (p.e. sucre) a poc a poc, observem que al principi es dissol sense dificultat, però que si en seguim afegint arriba un moment en què el dissolvent no és capaç de dissoldre més solut i aquest roman en estat sòlid, "acumulant-se" en el fons del recipient.
La quantitat màxima de solut que es pot dissoldre rep el nom de solubilitat i depèn de diversos factors:
a) De quins siguin el solut i el dissolvent. Hi ha substàncies que es dissolen millor en uns dissolvents que en altres.
b) De la temperatura. Normalment la solubilitat d'una substància augmenta amb la temperatura.
Com que les dissolucions es poden preparar barrejant quantitats variables de solut i dissolvent, és necessari establir una forma per poder indicar aquestes quantitats, el que es coneix amb el nom de concentració de la dissolució.
Una manera (molt poc precisa) d'indicar la concentració d'una dissolució és amb les paraules: diluïda, concentrada i saturada.
Dissolució diluïda: la que conté una quantitat petita de solut dissolt.
Dissolució concentrada: si té una quantitat considerable de solut dissolt.
Dissolució saturada: la que no admet més solut.
És fàcil entendre que expressar la concentració d'una dissolució usant els termes diluïda, concentrada o saturada és molt imprecís, per això la concentració s'expressa de forma numèrica de diverses formes.
3. MANERES D’EXPRESSAR LA CONCENTRACIÓ D’UNA DISSOLUCIÓ
Les unitats més freqüentment s’utilitzen per expressar la concentració d'una dissolució són les següents: Percentatge en massa, percentatge en volum, grams per litre i mols per litre o molaritat.3.1. El percentatge en massa (% en massa)
Expressa els grams de solut que es troben dissolts per cada cent grams de dissolució (no de dissolvent!).
Es calcula de la manera següent:
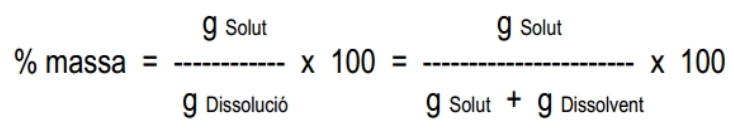
Les masses es poden expressar en qualsevol unitat de massa (en g o en kg...,això sí, cal escollir la mateixa unitat de massa tant pel numerador com pel denominador).
El resultat final s’expressa en % (les unitats de massa s'han simplificat).
3.2. El percentatge en volum (% en volum)
Expressa el volum de solut (litres, m3, cm3, ml, etc...) que es troba dissolt en 100 volums de dissolució. Aquesta unitat s'utilitza per dissolucions on el solut és líquid o gas. S'expressa en %.
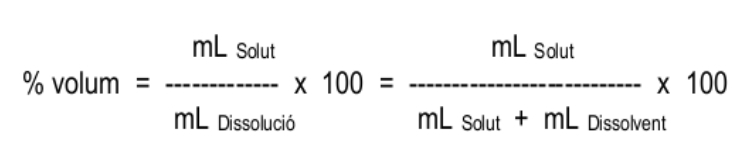
En la fórmula anterior hi ha expressat mL de solut entre mL de dissolució. És una manera d'expressar que cal dividir el volum de solut pel volum total de dissolució i que les unitats del numerador i del denominador han de ser les mateixes – poden ser però qualssevol unitats de volum: L, mL, dm3, m3...).
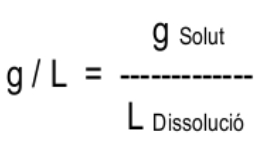
3.3. Els grams per litre (g/l) (també anomenat concentració en massa)
Expressen els grams de solut que es troben dissolts en un litre de dissolució. S'acostuma a utilitzar quan el solut és sòlid i el dissolvent és líquid. S'expressa en g/L
3.4.
La molaritat (M) Expressa
el nombre de mols de solut que es troben dissolts en un litre de
dissolució. És la més habitual en els laboratoris de química. El
dissolvent acostuma a ser líquid. Les unitats són mols/L.
Font: FisQuiWeb. http://web.educastur.princast.es/ IOC_Institut Obert de Catalunya