Teoria atòmica i taula periòdica
7. Nombres quàntics
Nombres quàntics
3.4.1 Digues els nombres quàntics possibles d'un electró situat en un orbital 4d.
En aquest exercici us demanen que escriviu totes les possibles combinacions de la forma ( n, l , ml , ms ) que pot adquirir un electró situat a l'orbital 4d.
Per tal de saber tots els diferents nombres quàntics possibles, heu de saber com es determina cada nivell quàntic a partir d'un orbital donat:
| Nombre quàntic principal (n) | Nombre quàntic secundari (l) | Nombre quàntic magnètic (mi) | Nombre quàntic de spin (ms) | |
|---|---|---|---|---|
| Es determina a partir del número
que indica el nivell de l'orbital. En aquest cas és 4 |
Es determina a partir de la lletra que indica el tipus d'orbital. (s=0; p=1; d=2 i f= 3)
En aquest cas és "d" i d és igual a 2 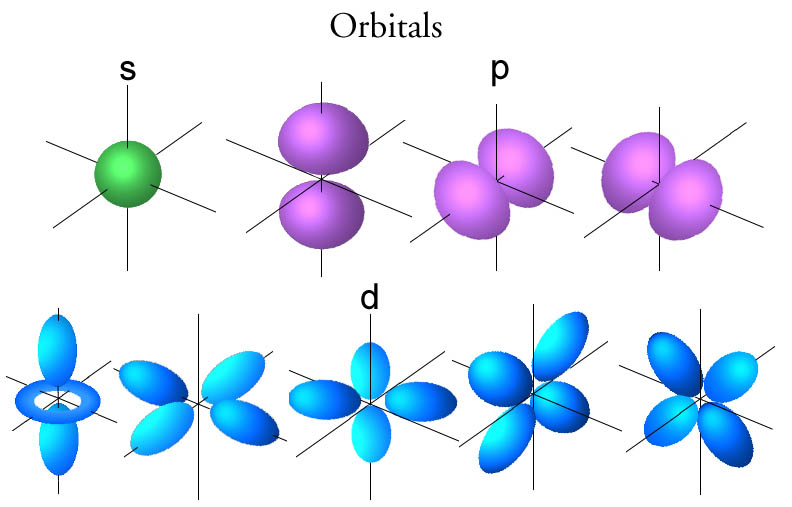 |
Es determina a partir del 0 i després se li suma i resta al 0 tots els nombres enters que hi ha entre el nombre quàntic secundari (l) i el 0.
En aquest cas és:
|
Es determina depenent de com gira l'electró en l'espai.
En aquest cas (i sempre) pot ser:
|
Atenent a les possibilitats concretes que hem determinat en la taula anterior podeu trobar totes les diferents combinacions que poden definir un electró del nivell 4d:
Combinacions (n, l , ml , ms)
- (4,2,-2,+1/2)
- (4,2,-2,-1/2)
- (4,2,-1,+1/2)
- (4,2,-1,-1/2)
- (4,2,0,+1/2)
- (4,2,0,-1/2)
- (4,2,+1,+1/2)
- (4,2,+1,-1/2)
- (4,2,+2,+1/2)
- (4,2,+2,-1/2)
