Teoria atòmica i taula periòdica
2. Exercicis de caracterització atòmica
2.1. Models atòmics
Models atòmics
2.1.1 E. Rutherford va a intuir l'existència del neutró abans que fos descobert
a) Digues en què es va basar i justifica les causes per les quals el neutró va ser la darrera partícula subatòmica a detectar-se.
b) Explica les evidències que suggereixen que el neutró ha de formar part del nucli atòmic.
En aquest tipus d'exercicis, simplement heu de saber la teoria relacionada amb els diferents models atòmics i explicar-la de manera clara i concisa:
a) E. Rutherford es va basar en la diferència trobada entre el càlcul de la possible massa atòmica d'un àtom (sumant les masses d'electrons i protons) i la massa atòmica trobada experimentalment. Això li va fer suposar que hi havia alguna altra partícula amb massa en l'àtom.
Fou la darrera partícula a detectar-se perquè els experiments realitzats fins aleshores eren de caràcter elèctric i, com que el neutró no té càrrega, passava desapercebut i no el van detectar.
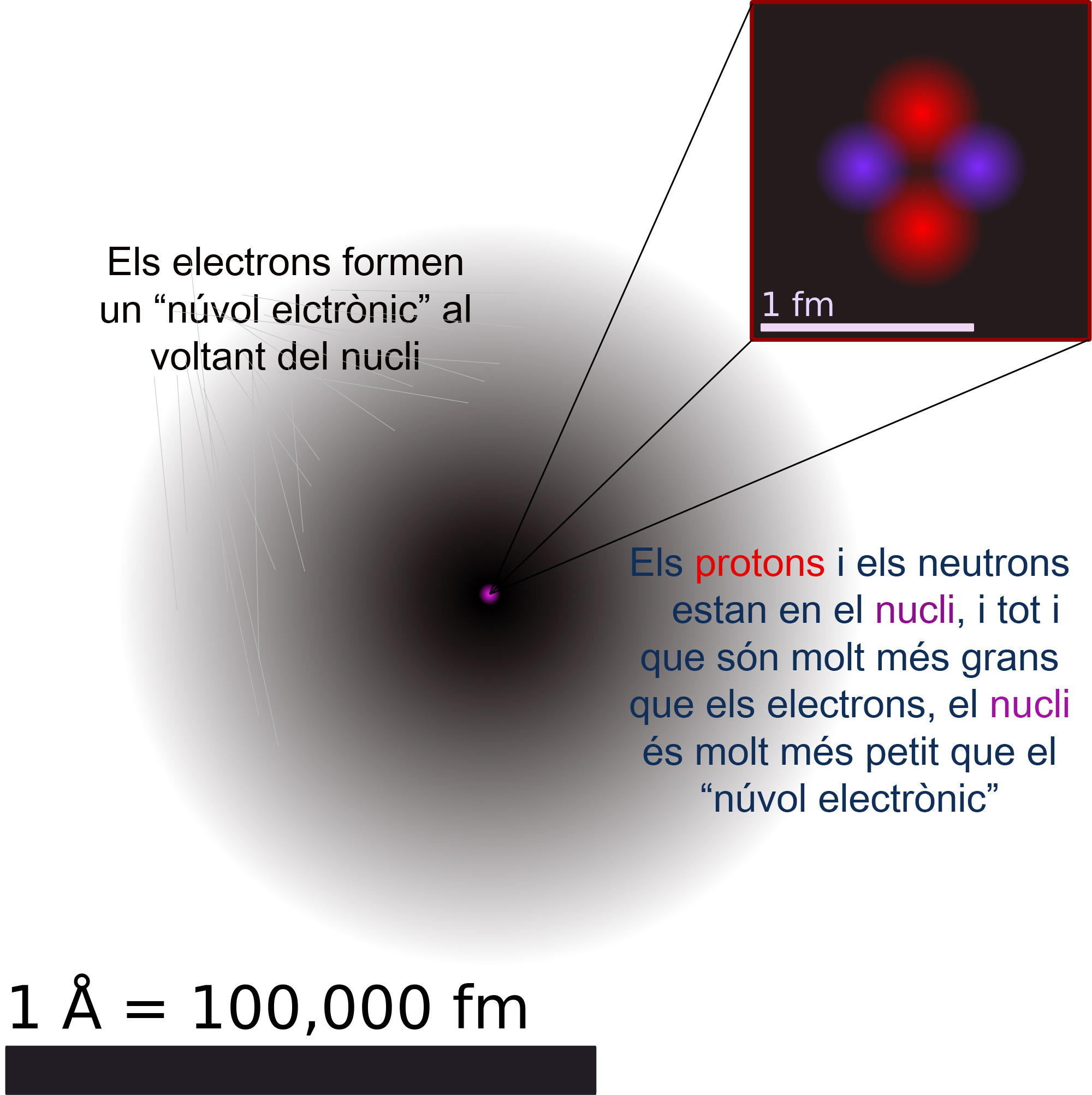
b) El fet que només algunes de les partícules a sortissin rebotades i no travessessin la làmina d'or, va fer pensar que la massa (protons i neutrons) es trobava concentrada en uns punts definits, els nuclis, responsables d'aquest efecte.
2.1.2 Justifica per què es va considerar revolucionària l'explicació de Planck sobre les emissions d'energia electromagnètica dels cossos a una temperatura determinada.
Es va considerar revolucionària perquè Planck va proposar que la radiació electromagnètica emesa pels cossos a una temperatura determinada només podia tenir uns valors concrets d'energia, que es podien calcular mitjançant una expressió matemàtica i que a més depenien de la freqüència de la radiació.
Aquesta energia només es podia emetre o absorbir en forma de paquets amb valors concrets, és a dir, l'energia estava quantitzada.
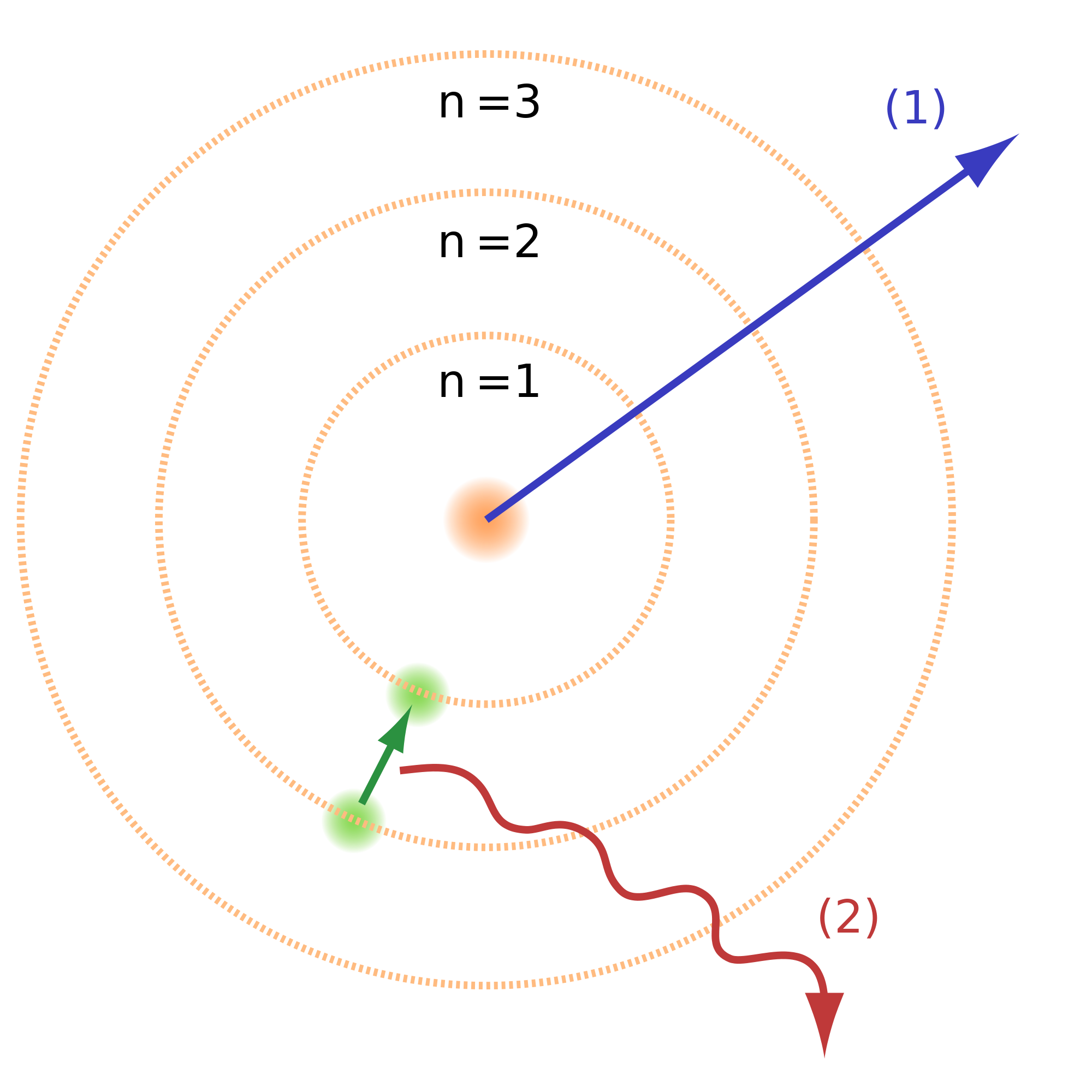
2.1.3 Digues per què el model de Rutherford no està d'acord amb l'espectre d'emissió dels àtoms.
No hi està d'acord perquè l'espectre d'emissió dels àtoms és discontinu, és a dir, hi ha emissió només en uns valors concrets d'energia . En canvi, segons el model atòmic de Rutherford, l'electró descriuria una espiral cap al centre de l'àtom, cap al nucli, perdria energia i l'emetria de forma continuad a.
2.1.4 Digues si un isòtop de carboni pot tenir el mateix nombre de massa que un isòtop de nitrogen. I el mateix nombre atòmic?
Un isòtop de carboni pot tenir diferent nombre de neutrons, però ha de tenir el mateix nombre de protons que un altre isòtop de carboni.
De la mateixa manera, un isòtop de nitrogen pot tenir diferent nombre de neutrons, però ha de tenir el mateix nombre de protons que un altre isòtop de nitrogen.
Seguint aquestes afirmacions, un isòtop de carboni sí que pot tenir el mateix nombre de massa que un isòtop de nitrogen, ja que la massa depèn del nombre de neutrons i protons. Per tant un isòtop de carboni pot tenir 6 protons i 6 neutrons = 12 i un isòtop de nitrogen pot tenir 7 protons i 5 neutrons = 12
Però el nombre atòmic (nombre de protons) no pot ser mai el mateix que el d'un isòtop de nitrogen, ja que els isòtops de carboni sempre tenen 6 protons i els de nitrogen sempre en tenen 7.