LLIURAMENT 3: Les proteïnes
| lloc: | Cursos IOC - Batxillerat |
| Curs: | Biologia I (Bloc 1) ~ gener 2020 |
| Llibre: | LLIURAMENT 3: Les proteïnes |
| Imprès per: | Usuari convidat |
| Data: | dimecres, 1 de maig 2024, 07:47 |
1. Les proteïnes
Són molècules complexes.
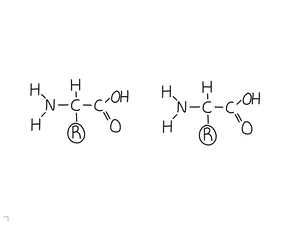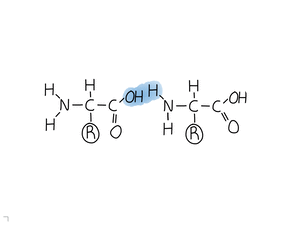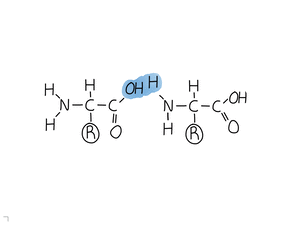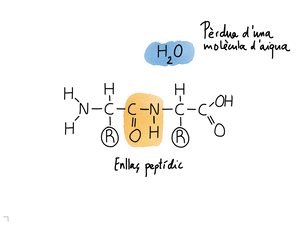
Formades per una cadena lineal d'aminoàcids, units amb enllaços peptídics.

Una proteïna és un polímer format per aminoàcids (monòmers).
Segons el nombre d'aminoàcids enllaçats, direm que és:
TRIPÈPTID: 3 aminoàcids
TETRAPÈPTID: 4 aminoàcids
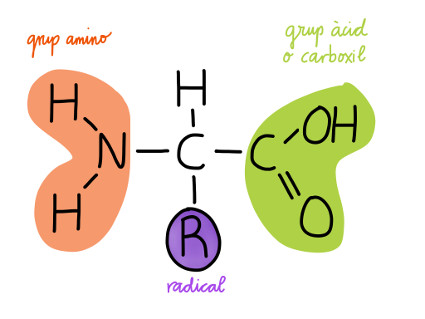
2. Els aminoàcids
- Són els monòmers que formen les proteïnes.
- Són molècules formades pels següents àtoms: C, H, O, N i, en alguns casos S.
- Hi ha 20 aminoàcids diferents, i tots tenen la següent estructura bàsica:
Una cadena lateral o radical (R) que és diferent en cada aminoàcid
2.1. Taula d'aminoàcids
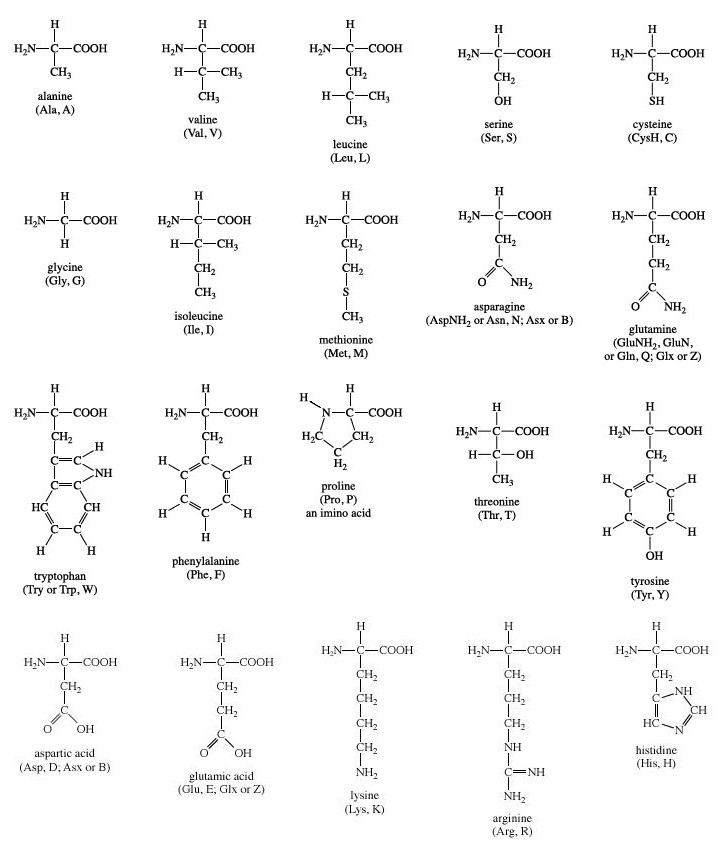
2.2. Llistat d'aminoàcids i codis de 3 lletres
Cal escriure sempre la primera lletra del codi de 3 lletres en majúscula
- Ala Alanina
- Arg Arginina
- Asn Asparagina
- Asp Aspartat
- Cys Cisteína
- Gln Glutamina
- Glu Àcid glutàmic
- Gly Glicina
- His Histidina
- Ile Isoleucina
- Leu Leucina
- Lys Lisina
- Met Metionina
- Phe Fenilalanina
- Pro Prolina
- Ser Serina
- Thr Treonina
- Trp Triptòfan
- Tyr Tirosina
- Val Valina
2.3. Classificació dels aminoàcids
Segons com és la cadena lateral o el radical, els aminoàcids es poden classificar en aquests grups:
- No polars o apolars o hidrofòbics: el radical és una cadena hidrocarbonada
- Ala / Gly / Val / Leu / Ile / Pro / Phe / Met / Trp / Cys
- Polars sense càrrega: cadena amb radicals que formen ponts d’hidrogen amb H2O
- Asn / Gln / Ser / Thr / Tyr
- Polars amb càrrega negativa o àcids: el radical té un grup àcid
- Asp / Glu
- Polars amb càrrega positiva o bàsics: el radical té un grup amino
- Arg / Lys / His
[Informació només de consulta, no s'ha de "memoritzar"]
4. Estructures de les proteïnes
Vegeu el vídeo explicatiu:
Els aminoàcids s'uneixen amb enllaços peptídics.
El primer aminoàcid té el grup amino lliure. El darrer aminoàcid té el grup carboxil lliure.
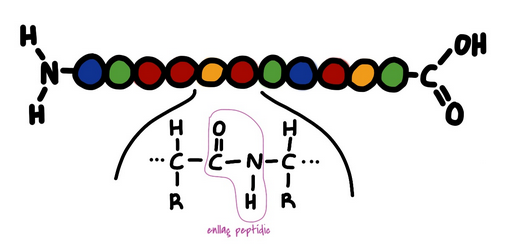
Els enllaços que mantenen aquesta estructura són ponts d'hidrogen entre aminoàcids no consecutius.
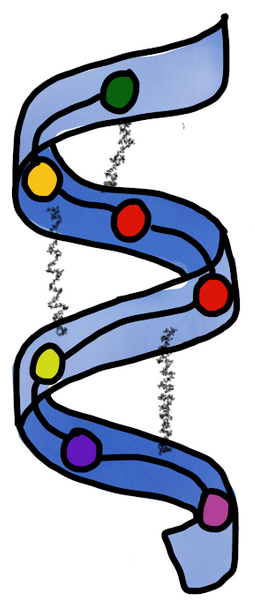

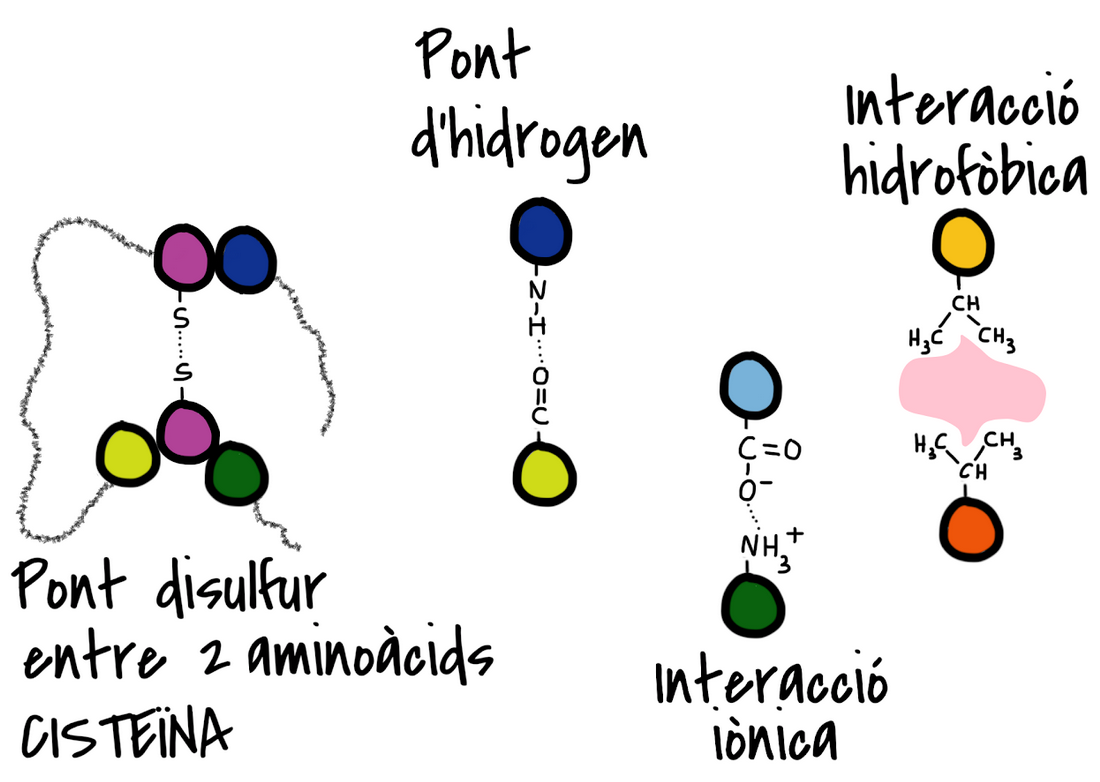
Les enllaços que mantenen aquesta estructura són:
- ponts disulfur
- ponts d'hidrogen
- interaccions iòniques
- interaccions hidrofòbiques
QÜESTIONARI FINAL
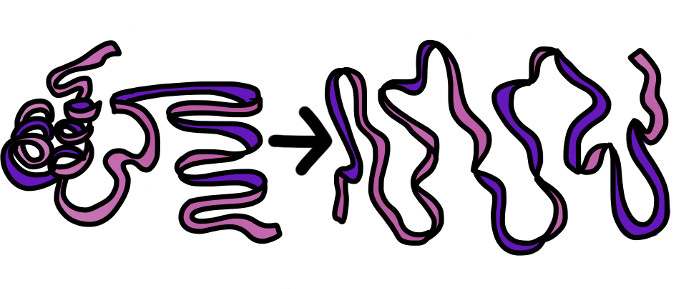
5. Desnaturalització
És la pèrdua de l'estructura a l'espai de la proteïna deguda a la calor, al pH., medi àcid..
Es "trenquen" les estructures quaternària, terciària i secundària.
La proteïna perd la seva activitat biològica.
En alguns casos, la proteïna es pot "renaturalitzar", és a dir, pot tornar a adquirir la seva conformació inicial.
6. Funcions
FUNCIÓ ESTRUCTURAL
- Proteïnes de membrana: formen part de les membranes de les cèl·lules
- Histones: associades a l'ADN formen els cromosomes
FUNCIÓ TRANSPORTADORA
- Hemoglobina: transporta oxigen
FUNCIÓ ENZIMÀTICA
- Enzims: biomolècules que catalitzen (acceleren) les reaccions químiques. les estudiarem amb mś detall al següent lliurament.
FUNCIÓ DEFENSIVA
- Anticossos o immunoglobulines que permeten identificar i neutralitzar elements estranys al cos. (S'estudiaran a Biologia II)
7. Els aminoàcids en medi aquós
Els aminoàcids en medi aquós es diu que són AMFÒTERS ja que es poden comportar, segons el pH, com a àcids o com a bases:
En un medi amb pH àcid, els aminoàcids es comporten com a bases i llavors capten protons H+.
Ho representem així:
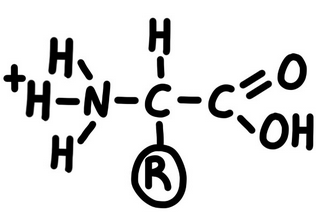
En un medi amb pH bàsic, els aminoàcids es comporten com a àcids i llavors alliberen protons H+.
Ho representem així:
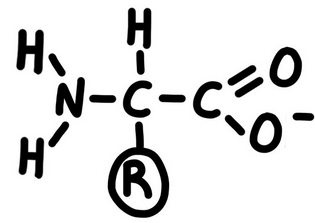
Cada aminoàcid té un punt de pH (el punt isoelèctric) en que actua a la vegada com a àcid (captant H+) i com a base (alliberant H+).
Ho representem així:
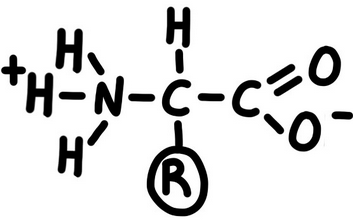
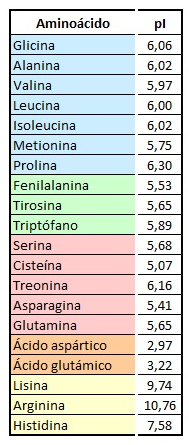
7.1. Punt isoelèctric dels aminoàcids
Cada aminoàcid té el seu punt isoelèctric característic en el que actua, a la vegada, com a àcid i com a base:
7.2. Exercicis
El punt isoelèctric de la glicina és 6,06. Digueu quina càrrega tindrà la glicina si el medi en que es troba té els següents pH:
- pH=4
- pH=5
- pH=6
- pH=6,06
- pH=7
- pH=12
Per exemple:
1. Si el pH és 4,:
↓
és un pH àcid
↓
la glicina es comportarà com una base
↓
captarà protons
↓
tindrà càrrega +
VEGEU LES RESPOSTES
8. Així doncs, què cal saber?
Al final del lliurament hauríeu de ser capaços de:
- Saber reconèixer en un aminoàcid: la part variable, el grup amino i el grup àcid
- Saber perquè els aminoàcids són amfòters
- Resoldre exercicis senzills del comportament dels aminoàcids en medi aquós
- Entendre com es forma l'enllaç peptídic i saber enllaçar aminoàcids
- Conèixer les estructures de les proteïnes i, en cada cas, quins enllaços les estabilitzen
- Saber com es pot provocar la desnaturalització de les proteïnes i què comporta
- Conèixer les principals funcions de les proteïnes