LLIURAMENT 2: L'aigua i les sals minerals
| lloc: | Cursos IOC - Batxillerat |
| Curs: | Biologia I (Bloc 1) ~ gener 2020 |
| Llibre: | LLIURAMENT 2: L'aigua i les sals minerals |
| Imprès per: | Usuari convidat |
| Data: | dissabte, 27 d’abril 2024, 23:01 |
1. Les biomolècules inorgàniques
Són les biomolècules que es poden trobar tant a la matèria viva com a la matèria inerta.
Són l'aigua i les sals minerals.
2. L'aigua
- És el medi on es va originar la vida
- És el component principal dels éssers vius i és imprescindible per la vida
- Mantenir l'equilibri de la quantitat d'aigua a l'organisme és molt important i cal equilibrar les entrades i les sortides:
| ENTRADES | SORTIDES |
|---|---|
|
|
- Es troba en diferent proporció en els éssers vius. Per exemple les meduses en tenen un 95%, els cucs de terra 83%, els humans 70%, els pins 47% o els cereals 20%
- Dins d'un mateix organisme, per exemple els humans, cada teixit o cada òrgan té aigua en diferent proporció: des de les dents que només tenen 8-10% fins el cervell o els ronyons que en poden tenir un 80%.
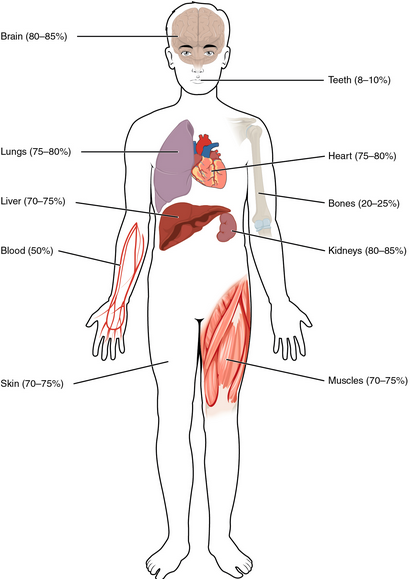
- L'aigua es troba als organismes de tres maneres diferents.
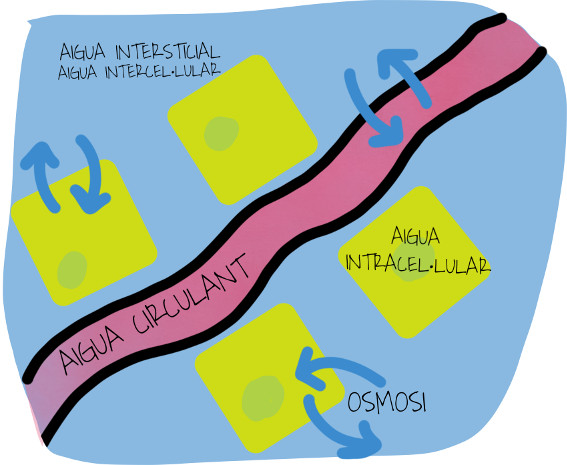
AIGUA CIRCULANT
- pels vasos sanguinis dels animals
- pels vasos conductors de les plantes: la saba
AIGUA INTERSTICIAL
- és la que hi ha entre les cèl·lules
AIGUA INTRACEL·LULAR
- és la que hi ha dins de les cèl·lules
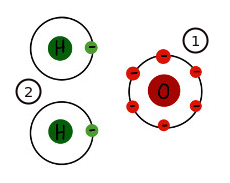
2.1. La molècula d'aigua
Una molècula d'aigua consta d'un àtom d'oxigen i dos àtoms d'hidrogen units mitjançant enllaços covalents:
|
|
1. L'àtom d'oxigen té 6 electrons a la capa més externa 2. Els àtoms d'hidrogen tenen 1 electró |
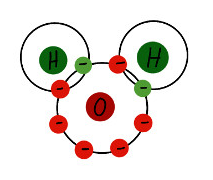 |
Els àtoms comparteixen electrons per tenir una configuració més estable. D'aquesta manera:
|
 |
Però les electrons no es comparteixen per igual.
|
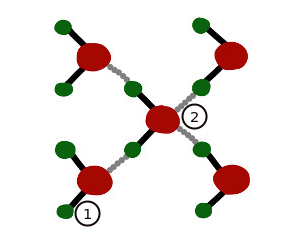 |
Les molècules d'aigua s'uneixen entre elles mitjançant enllaços de tipus pont d'hidrogen o enllaç d'hidrogen (2-de color gris). Es formen:
Ara torneu a mirar la icona d'aquest segon lliurament, veieu els ponts d'hidrogen? Mireu el recurs: ANIMACIÓ: Construcció de la molècula d'aigua |
2.2. Propietats i importància biològica
- Té una elevada calor específica:
- és a dir, es necessita molta calor per pujar la temperatura: és un bon estabilitzador tèrmic
- Té una elevada calor de vaporització:
- és a dir, es necessita molta energia per evaporar l'aigua: és un bon refrigerant en la transpiració
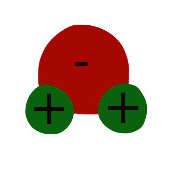
- És una molècula polar:
- és a dir, la càrrega elèctrica és zero, però és un dipol perquè una zona és positiva i l'altra és negativa per una distribució desigual dels electrons: es dissolen bé les sals i les substàncies polars (hidròfiles)
- Té una elevada tensió superficial:
- la superfície és com una làmina→alguns insectes poden caminar pel damunt
- El gel sura sobre l'aigua líquida perquè és menys densa:
- Això és molt important per la vida als ecosistemes aquàtics. El gel fa una capa superior en alguns llacs, però la vida pot continuar per sota.
- Però... per què passa? Ho teniu molt ben explicat en aquest VÍDEO: Per què floten els glaçons de gel? (00:03:55). També us anirà bé per acabar de consolidar conceptes com ara l'enllaç covalent i l'enllaç d'hidrogen.
- Si el voleu veure amb subtítols seguiu aquestes instruccions.
- Dissol moltes substàncies -> és important perquè llavors les substàncies reaccionen millor
- Transporta substàncies dins l'organisme
- Dona volum i forma a moltes cèl·lules (funció estructural)
- Regula la temperatura: quan s'evapora l'aigua (suant o transpirant) es perd calor i baixa la temperatura del cos
- Participa en moltes reaccions químiques (funció metabòlica)
3. Osmosi
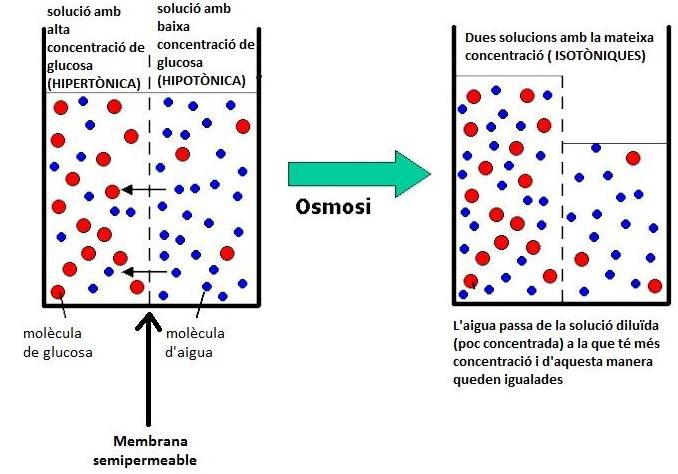
L'osmosi és un tipus especial de transport de molècules d'aigua a través de la membrana de les cèl·lules que no requereix despesa d'energia.
L'osmosi en els éssers vius és un mecanisme fonamental per a sobreviure quan canvien les condicions de salinitat. Amb l'osmosi -el pas de molècules d'aigua per la membrana en un o altre sentit- s'aconsegueix que hi hagi equilibri de les concentracions i que la cèl·lula pugui fer les seves funcions.
Ho veurem amb aquest esquema:- és un recipient amb dos compartiments
- estan separats per una membrana semipermeable:
- seria similar a la membrana cel·lular
- deixa passar l'aigua, però no les molècules de solut (en aquest exemple són molècules de glucosa)
Vegeu les següents animacions:
- Transport passiu osmosi
- Transport passiu osmosi interactiu
- ANIMACIÓ: Osmosi (compte!: els glòbuls vermells no tenen ulls!)
També teniu una activitat d'aprenentatge no avaluable, però imprescindible abans de fer el qüestionari avaluable:
4. Les sals minerals
Les podem trobar als éssers vius de tres formes.
(Reviseu el que s'ha treballat al primer lliurament)
Poden formar:
- l'endoesquelet: carbonat de calci i fosfat de calci del ossos
- l'exoesquelet:
- diòxid de silici de les diatomees
- carbonat de calci i fosfat de calci de les closques dels mol·luscs i els equinoderms
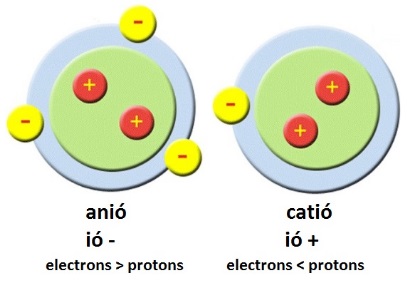
Quan estan en dissolució, es troben en forma d'ions que són necessaris per algunes reaccions:. Funció reguladora.
5. El pH
El pH és una mesura quantitativa de l'acidesa o basicitat d'una dissolució, que ve determinada per la quantitat de H+que hi ha a la dissolució.
Té una escala que va del 0 al 14:- el nombre 7 determina el pH neutre
- els valors inferiors a 7 indiquen acidesa
- valor més petit → més àcid
- exemples:
- suc de llimona, pH ≈ 2,3
- vinagre, 2,4 ≤ pH ≤ 3,4
- suc gàstric, 1,0 ≤ pH ≤ 3,0.
- els valors superiors a 7 indiquen basicitat (més bàsic com més gran és el nombre).
- valor més gran → més bàsic
- exemples:
- sabons, 9,0 ≤ pH ≤ 11,5
- amoníac pH ≈ 11,5
- lleixiu; pH ≈ 12,5
6. Logaritmes
Com hem vist el pH indica la concentració de H+ que té una substància, però com són quantitats molt petites, utilitzem els logaritmes.
Així doncs el pH és el logaritme negatiu de la concentració molar d'ions hidrogen. És a dir:
- pH = – log [H+]
Però mirem-ho amb exemples!
si hi ha una concentració de 0,000001:
- [H+] = 0,000001
posem la xifra com a potència de 10:
- [H+] = 10-6
el logaritme de 10-6 és:
- log 10-6 = - 6
Com que el pH és el logaritme negatiu, llavors li canviem el signe:
- pH = 6
Proveu si hi heu entès calculant els pH d'aquest solucions:
- Quin és el pH d'un solució (A) que té una concentració [H+] = 0,001?
- Quin és el pH d'una solució (B) que té una concentració [H+] = 0,000000000001?
- Quina solució té una concentració més alta de [H+]?
- Digueu quina és àcida i quina és bàsica
7. Així doncs, què cal saber?
Al final del lliurament hauríeu de ser capaços de:
- Conèixer l'estructura molecular de l'aigua: els àtoms i enllaços entre ells
- Entendre què significa que és una molècula dipolar
- Saber com s'estableixen els enllaços entre diferents molècules d'aigua
- Conèixer les principals propietats i funcions de l'aigua
- Saber calcular el contingut d'aigua d'aliments
- Saber què són els anions i els cations
- Conèixer les funcions de les sals minerals
- Determinar si una solució és hipertònica, hipotònica o isotònica en comparació amb una altra
- Entendre
el concepte d'osmosi (saber en quin sentit l'aigua travessa la membrana
d'una cèl·lula en funció de les concentracions que hi ha)
- Entendre què mesura el pH
- Saber interpretar en l'escala de pH, quan una substància és àcida, bàsica i neutra